Protein sốc nhiệt là gì? Liệu protein có thể giúp chúng ta chống lại ung thư?
Các nhà khoa học Nga tuyên bố đã thử nghiệm thành công một loại thuốc sốc nhiệt protein chữa khỏi mọi loại ung thư. Trong khi thuốc này còn phải chờ kiểm chứng trong thực tế thì chúng ta nên biết protein sốc nhiệt là gì? Và nó có khả năng chữa ung thư như thế nào?
Theo định nghĩa của Viện Ung thư quốc gia (Mỹ), protein sốc nhiệt là một trong một nhóm protein giúp bảo vệ tế bào khỏi các loại căng thẳng (stress) như nhiệt, lạnh, và thiếu glucose (đường) hoặc oxy. Protein sốc nhiệt giúp các protein khác hoạt động trong các tế bào bình thường và có thể hiện diện ở mức cao trong các tế bào ung thư. Chặn hoạt động của một protein sốc nhiệt gọi là HSP90 đang được nghiên cứu trong điều trị ung thư. Các protein sốc nhiệt khác bao gồm HSP70 và gp96 đang được nghiên cứu trên vắcxin để điều trị ung thư. Protein sốc nhiệt còn được gọi là HSP hoặc stress protein.
Còn theo Wikipedia, protein sốc nhiệt (HSP) là một họ các protein được sản xuất bởi các tế bào để đáp ứng với những điều kiện căng thẳng. Chúng được mô tả lần đầu tiên trong mối quan hệ với cú sốc nhiệt nhưng hiện cũng được thể hiện trong các cú sốc khác bao gồm tiếp xúc với lạnh, tia UV, và trong quá trình chữa lành vết thương hoặc thay mô. Nhiều thành viên của nhóm này thực hiện chức năng chaperone (đi kèm theo) bằng cách ổn định các protein mới để đảm bảo sự cuộn gấp chính xác hoặc bằng cách giúp tái tạo protein đã bị hư hỏng do tế bào stress. Sự tăng biểu hiện này được điều hòa ở cấp độ phiên mã. Sự gia tăng đột ngột các protein sốc nhiệt là một phần quan trọng của phản ứng sốc nhiệt và được gây ra chủ yếu bởi hệ số gây sốc nhiệt (HSF). HSP được tìm thấy trong hầu hết các sinh vật sống, từ vi khuẩn đến con người.
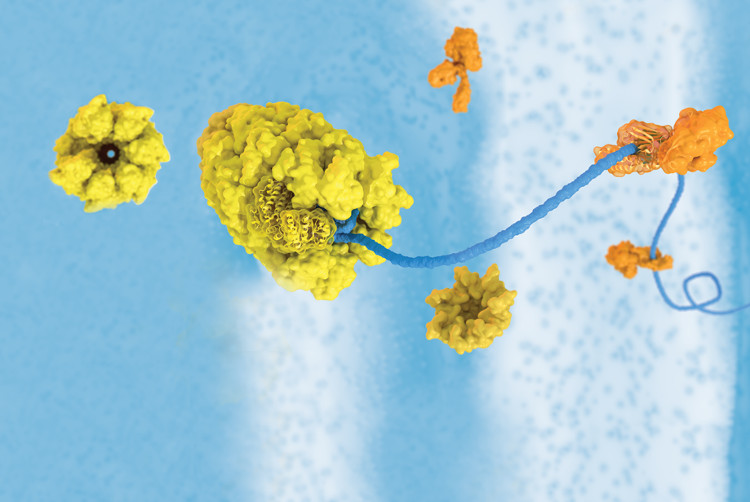
Protein sốc nhiệt là một trong một nhóm protein giúp bảo vệ tế bào khỏi các loại căng thẳng.
Protein sốc nhiệt được đặt tên theo khối lượng phân tử của chúng. Ví dụ, HSP60, HSP70 và HSP90 (các HSP được nghiên cứu nhiều nhất) để chỉ các họ của protein sốc nhiệt theo thứ tự lần lượt là 60, 70 và 90 kilodalton. Dựa trên khối lượng phân tử, HSP được chia thành 5 nhóm chính: HSP27, HSP60, HSP70, HSP90 và HSP110/104.
Theo Science Direct, protein sốc nhiệt ngăn ngừa việc hình thành các khối u protein không đặc hiệu và chúng hỗ trợ các protein trong việc thu nhận kiến trúc bình thường của chúng. Ngoài ra, các protein sốc nhiệt có thể có tính chất chống tế bào rụng chết và tích cực tham gia vào các quá trình khác nhau như sự gia tăng tế bào khối u, xâm lấn, di căn và tử vong.
Đáng chú ý, các protein này đã được báo cáo là tăng đáng kể trong một loạt các bệnh ung thư ở người. Sự biểu hiện quá mức của chúng liên quan chặt chẽ với sức đề kháng điều trị và khả năng sống sót thấp. Bằng cách này, các HSP có thể có ý nghĩa điều trị quan trọng và chúng có thể được nhắm mục tiêu theo các loại thuốc cụ thể.
Nói tóm lại, từ lâu các nhà khoa học đã biết protein sốc nhiệt hiện diện trong mỗi tế bào để chống lại stress. Các nhà nghiên cứu sau này đã phát hiện ra công dụng mới của nó khi nó đóng vai trò tích cực giúp hệ miễn dịch xác định các tế bào ung thư để phản ứng lại kịp thời. Tuy nhiên, việc tổng hợp được nó để điều trị ung thư vẫn còn đang trong quá trình nghiên cứu.
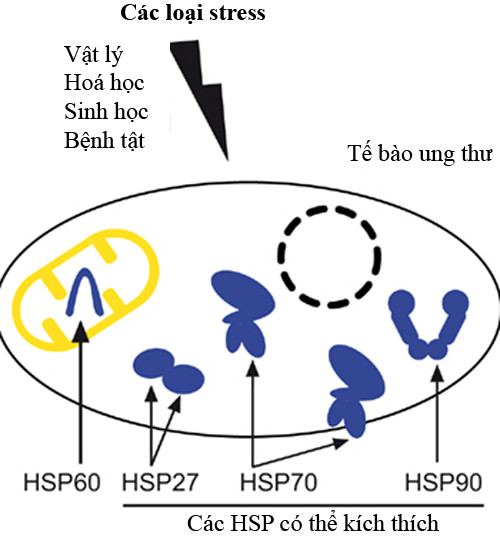
Các căng thẳng có nguồn gốc vật lý, hoá học hoặc sinh học, cũng như các bệnh như ung thư có thể gây ra sự tích tụ protein sốc nhiệt cần thiết cho sự sống còn của các tế bào ung thư. Trong ảnh là minh hoạ cho việc bản địa hóa chính của HSP60, hiện diện trong ty thể, và 3 protein sốc nhiệt hạt nhân kích thích: HSP27, HSP70 (cũng được tìm thấy trong màng tế bào) và HSP90. (Nguồn: Frontiers).
Vai trò của protein sốc nhiệt
Vai trò chính: Giữ trật tự
Các protein sốc nhiệt đi kèm các protein tế bào khác, bảo vệ chúng khỏi bị lạc đường, cuộn gấp không đúng cách hoặc lắp sai trong khi tạo thành các khối lớn hơn, như trong các ví dụ dưới đây:
- HSP40 cung cấp một chuỗi axit amin mới hình thành cho HSP70, protein này "tóm" lấy phân tử, giúp nó gấp cuộn thành dạng chức năng thích hợp và sau đó giải phóng nó.
- HSP60 thu hút một chuỗi axit amin mới hoặc một protein đã bị mất cấu trúc và tiếp nhận nó. Các liên kết hoá học trong lồng giúp cho protein giả định hình dạng cuộn gấp là đúng.
- HSP90 nhận các protein cuộn gấp từ các phân tử chaperone và giúp kết hợp chúng thành một cấu trúc protein lớn hơn, như một thụ thể tế bào.
Nhiệm vụ thứ hai: Kích hoạt các phản ứng miễn dịch
Khi một tế bào bị ung thư hoặc bị nhiễm bởi một mầm bệnh, nó tạo ra các protein mà trong các tế bào bình thường không có. Các phân mảnh của những tế bào như vậy sau đó có thể có khả năng hoạt động như các kháng nguyên, chất kích thích phản ứng miễn dịch. Nhưng các tế bào miễn dịch trước tiên phải nhận thức được vấn đề. Protein sốc nhiệt, chủ yếu là thành viên của các họ HSP90 và HSP70, tham gia báo động và xác định thủ phạm.
- HSP cung cấp các kháng nguyên từ các tế bào bị bệnh đến các tế bào trình diện kháng nguyên (APC) của hệ thống miễn dịch, thông qua một thụ thể bề mặt được gọi là CD91.
- Sau khi bắt giữ các kháng nguyên, APC phát đi các tín hiệu viêm để tuyển các tế bào miễn dịch khác và trình bày kháng nguyên đó trên bề mặt của nó đến một tế bào T.
- Do đặt ưu tiên phát hiện kháng nguyên đích, tế bào T sinh sôi nảy nở và cùng với những người anh em của mình tìm kiếm để diệt các tế bào bệnh.
Theo tạp chí Discovery Medicine, mối quan hệ giữa HSP và miễn dịch khối u được tiết lộ khoảng 3 thập kỷ trước, khi các nhà nghiên cứu phát hiện rằng việc tiêm phòng động vật với các HSP được tinh chế từ các tế bào khối u đã gây ra sự miễn dịch đặc hiệu chống lại khối u. Tuy nhiên, các HSP được sẵn sàng từ các tế bào bình thường lại không sản sinh ra miễn dịch. Kể từ đó, một số HSP bắt nguồn từ khối u đã được điều tra như vắc-xin khối u hoặc trong mô hình động vật hoặc bệnh nhân u hắc tố. Các HSP này bao gồm HSP70, HSP110, protein điều chỉnh lượng glucose GRP78, GRP94 (còn gọi là gp96) và GRP170 và lysate toàn bộ tế bào chaperone.
Mặc dù vậy, việc điều trị ung thư sử dụng cơ chế protein sốc nhiệt vẫn chưa đạt được nhiều tiến bộ. Cho đến đầu tháng Ba vừa qua, truyền thông Nga đưa tin các nhà khoa học nước này tuyên bố tìm ra phương thuốc chữa trị mọi loại ung thư, kể cả ung thư giai đoạn cuối. Đó là biện pháp protein sốc nhiệt.

Nhà khoa học Nga Andrei Simbirtsev.
Ông Andrei Simbirtsev, Phó Viện trưởng Viện Y - Sinh liên bang cho biết lượng protein sốc nhiệt tự nhiên tồn tại trong cơ thể người là rất ít, nhưng đến nay các nhà khoa học Nga đã tổng hợp thành công nó. Họ đã tạo ra một loại gene của con người chuyên sản xuất ra protein này để rồi nhân bản nó lên.
Các nhà khoa học Nga cho biết họ đã thử nghiệm tiền lâm sàng loại thuốc này thành công trên chuột khi bị u ác tính, và ghi nhận rằng protein sốc nhiệt hoạt động rất hiệu quả đối với mọi giai đoạn của bệnh mà không hề có tác dụng phụ hay độc tính nào.
Thành công của loại thuốc mới được các nhà khoa học Nga tìm ra nhờ vào các thí nghiệm trên vũ trụ, nơi có môi trường thích hợp (không có sức hút của Trái Đất) để tạo ra một loại tinh thể siêu tinh khiết phục vụ cho công tác phân tích X-quang. Các nhà khoa học Nga đã đựng protein siêu tinh khiết trong ống vi mạch và gửi lên Trạm Vũ trụ. Sau 6 tháng "du hành" trong ống vi mạch sẽ thu được loại tinh thể lý tưởng và chuyển về phân tích tại Nga và Nhật Bản.
Loại thuốc protein sốc nhiệt này dự kiến sẽ được đưa vào sản xuất sau 3-4 năm nữa.
Trong khi truyền thông phương Tây dè dặt với thông tin này (hầu như không thấy có tờ báo Anh, Mỹ hay các nước phát triển khác đưa tin về thành tựu này), và chúng ta còn phải chờ thêm vài năm nữa mới có thể kiểm chứng lời tuyên bố của các nhà khoa học Nga, nhưng chúng ta có thể hy vọng rằng với sự tiến bộ của khoa học, công nghệ, tất cả những vấn đề nan giải của đời sống, như căn bệnh hiểm nghèo ung thư sẽ dần được giải quyết.
Y học - Sức khỏe
-

Humvee trở thành huyền thoại xe quân sự như thế nào?
-

Cách để "thức cả đêm" mà không mệt mỏi theo kinh nghiệm của NASA
-

Vật thể cách xa 19,5 tỉ năm ánh sáng "xuyên không" đến Trái đất
-

Nhà khoa học Trung Quốc tạo ra "đứa trẻ" AI đầu tiên trên thế giới
-
3,5 triệu USD là giá tiền cho loại thuốc đắt nhất thế giới
-
Bạn có biết: Máu trong cơ thể phi hành gia chảy khác hẳn khi trong không gian















