Vì sao bảng tuần hoàn các nguyên tố hóa học lại “tuần hoàn”?
Các nguyên tố tương tác với nhau thông qua electron của chúng. Cách electron tương tác với các nguyên tử khác (hoặc bức xạ điện từ) sẽ quyết định tính chất của nguyên tử đó.
Chúng ta có thể thấy rõ điều này thông qua các đồng vị. Các nguyên tố khác nhau được phân biệt bởi số proton có trong hạt nhân của mỗi nguyên tố. Trong khi đó, nếu thay đổi số neutron lại không làm thay đổi quá nhiều tính chất của nguyên tố. Vì sao lại vậy?

Các electron được "chứa" trong nguyên tử theo một cấu hình nhất định. (Ảnh: Getty Images).
Thật ra, không phải proton là thứ làm thay đổi tính chất của nguyên tố, thay vào đó, sự thay đổi số lượng điện tích dương (proton) sẽ dẫn đến sự thay đổi số điện tích âm (electron) mà nguyên tố có thể giữ và từ đó làm thay đổi tính chất của nguyên tố đó. Với số lượng electron khác nhau, đặc biệt là số electron hóa trị (ở lớp ngoài cùng) của nguyên tử, sẽ tạo ra những tính chất khác nhau. Việc thay đổi số neutron sẽ làm biến đổi hạt nhân nhưng lại ít tác động đến khả năng tương tác của electron, vì vậy, chúng ít ảnh hưởng đến khả năng hóa học của nguyên tử.
Vậy điều này liên quan gì đến tính "tuần hoàn" của bảng tuần hoàn hóa học? Thật ra, các electron được "chứa" trong nguyên tử theo một cấu hình nhất định. Chúng được gọi là obitan nguyên tử. Để giải đáp cho câu hỏi này sẽ cần kha khá kiến thức về cơ học lượng tử, nhưng về cơ bản là các obitan nguyên tử sẽ có sự lặp lại. Cụ thể là số lượng tử xung lượng l sẽ biểu hiện hình dạng obitan nguyên tử. Mỗi quỹ đạo tương ứng với số lượng tử chính n (gần đúng). Với mỗi lớp n, sẽ có những phân lớp ls đi kèm. Theo quy ước, các obitan nguyên tử có số lượng tử xung lượng l khác nhau sẽ được gắn nhãn lần lượt là s, p, d, f...
Đó là lý do vì sao bạn thấy có sự tuần hoàn trong bảng các nguyên tố hóa học. Các nguyên tố có số electron vừa đủ lấp đầy obitan s và p là nguyên tố bền nhất và mỗi n có một cụm s và p riêng. Vì vậy, khi bạn viết cấu hình electron của một nguyên tố có số electron vừa đủ lấp đầy phân lớp s và p thì đó là cấu hình electron của một khí hiếm. Với nhóm halogen (như clo hay brom), bạn chỉ cần thêm 1 electron nữa là đủ cấu hình obitan s và p, có thể hiểu là thêm 1 electron vào cấu hình nhóm halogen ta sẽ được cấu hình khí hiếm. Ngược lại, với kim loại kiềm (như natri và kali) chỉ cần lấy đi 1 electron của kim loại này ta sẽ được cấu hình của khí hiếm, do vậy mà nhóm này thường có xu hướng mang điện tích dương. Đó là cách các nguyên tử lấp đầy electron vào các obitan s và p, bất kể số lượng tử chính n. Và chính điều này đã góp phần lớn vào việc tạo nên tính "tuần hoàn" của bảng tuần hoàn các nguyên tố hóa học.
Như vậy, hóa ra các obitan s và p lại là phân lớp "hoạt động" nhiều nhất và nó đóng vai trò chính trong việc biểu thị hầu hết tính chất của các nguyên tố. Các nguyên tố chỉ khác nhau về số electron trong obitan d có ít sự khác biệt hơn, đó là lý do vì sao các kim loại chuyển tiếp có tính chất tương tự nhau. Với các nguyên tố có sự khác nhau về số electron trong obitan f (như họ Lantan) thậm chí còn có tính chất tương đồng nhau nhiều hơn. Tuy có khác nhau nhưng nó biểu thị ở những đặc điểm tinh tế hơn so với nhưng điểm tạo nên sự khác biệt trong nhóm kim loại kiềm / phi kim / halogen / khí hiếm.
Lưu ý rằng tính tuần hoàn trong bảng tuần hoàn các nguyên tố hóa học dần bị phá vỡ khi xuống cuối bảng. Đó là vì càng về sau, bạn sẽ bắt đầu thấy những quy luật trên chỉ mang tính tương đối và cách các obitan hoạt động dần thay đổi. Như vậy, có thể nói tính "tuần hoàn" trong bảng tuần hoàn các nguyên tố hóa học chỉ mang tính xu hướng, không phải tuyệt đối.
- Bảng tuần hoàn Mendeleev thêm nguyên tố mới -117
- Sắp có bảng tuần hoàn hóa học mới
- Bảng tuần hoàn hóa học có "thành viên" mới
- Xác nhận sự tồn tại của nguyên tố hóa học thứ 117
- Kỷ niệm 150 năm bảng tuần hoàn các nguyên tố hóa học
- Nguồn gốc tên gọi của các nguyên tố hóa học
- Bảng tuần hoàn hóa học có dài mãi?
Khám phá
-
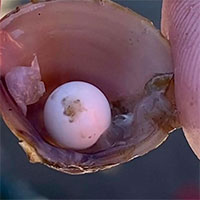
Nhóm học sinh vô tình phát hiện ngọc siêu hiếm bên trong con hến
-

“Truyền nhân” của nhà tiên tri Vanga dự đoán gì đầu tiên?
-

Chim sâu và những thông tin cơ bản về loài chim này
-

Gặp điều kỳ quặc này, bạn có thể là "con lai" của loài người khác
-

Liệu chúng ta có thể bị “nhờn” cà phê khi uống quá nhiều?
-

Tìm hiểu cuộc đời của nhà tiên tri mù Vanga
Tại sao
-

Tại sao trong lăng mộ Tần Thủy Hoàng lại có Ngũ thạch tán?
-

Tại sao thiếu ngủ có thể khiến cơ thể dễ bị nổi mụn?
-

Tại sao Mặt trời lại có màu trắng vào buổi trưa và màu đỏ khi bình minh và hoàng hôn?
-

Vì sao con người sợ bóng tối?
-

Tại sao những ngày nóng rẫy tháng 7 gọi là "những ngày chó"?
-

Vì sao nước cam biến mất khỏi kệ hàng nhiều nơi trên thế giới?